專家小組近全員反對 美阿茲海默症新藥仍准上市
香港文匯報綜合美聯社、路透社、法新社報道:美國食品及藥物管理局(FDA)前日以加速審批方式,批准一款治療早期阿茲海默症(Alzheimer's Disease)的新藥,是18年來首次。新藥的審批過程充滿爭議,FDA的獨立專家小組去年曾經以沒有足夠證據證明這款藥物的療效為由,建議不予批准藥物上市,不過FDA則認為藥物有效減少大腦中的「Beta類澱粉蛋白」斑塊,對患者的好處大於風險,決定以上市後繼續臨床試驗的方式批准新藥,一旦臨床試驗無法證明效果,將會撤回許可。
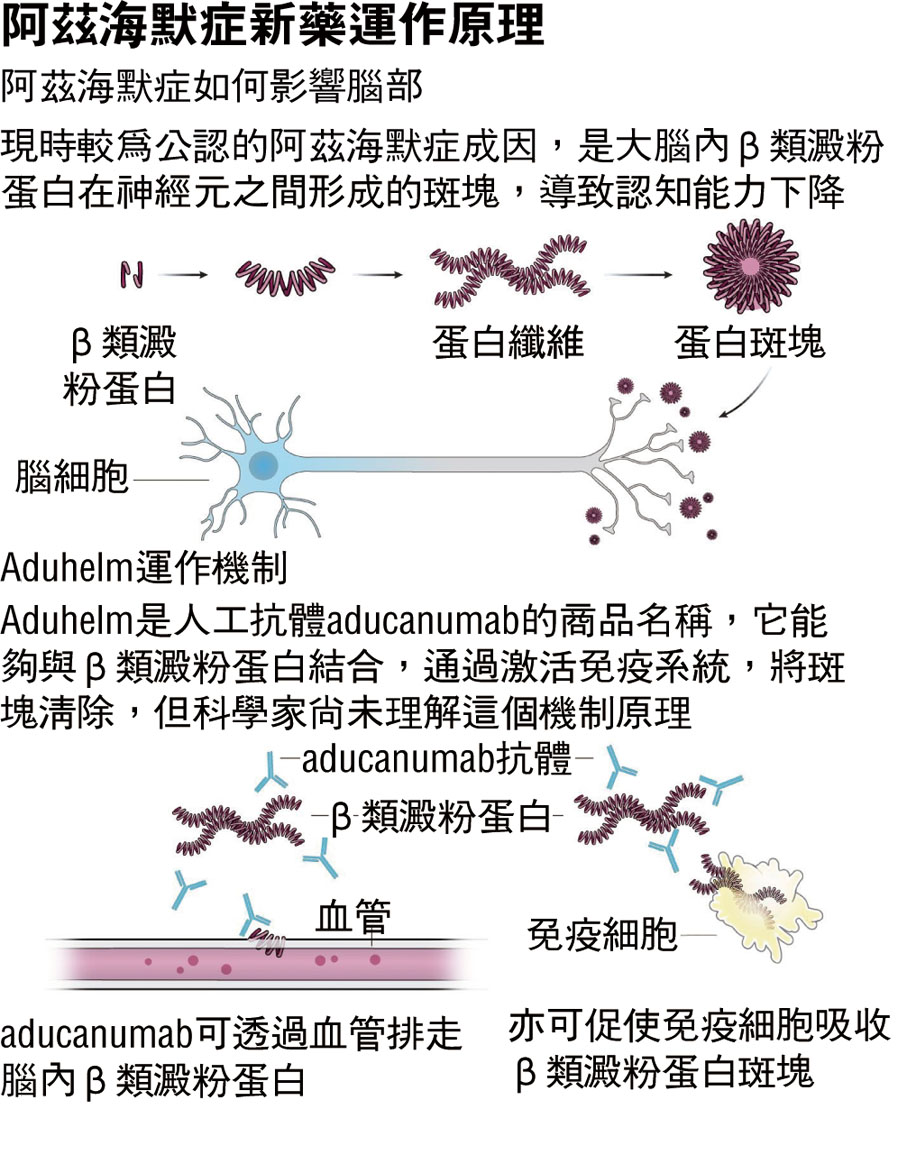
目前醫學界對於阿茲海默症的成因未有定論,不過比較公認的發病機制為,人腦內Beta類澱粉蛋白的生成和清除失衡是神經元變性和認知障礙發生的始動因素,異常水平的Beta類澱粉蛋白在大腦神經元之間形成的斑塊具有神經毒性,導致神經元變性,最終令患者認知能力下降。
今次獲批的新藥由美國藥廠Biogen研發,商品名為Aduhelm(學名aducanumab,阿杜卡瑪單抗),它據稱能夠與阿茲海默症患者大腦中的Beta類澱粉蛋白沉積結合,然後通過激活免疫系統,將大腦中的沉積蛋白清除,從而治療因為阿茲海默症引起的輕度認知障礙和早期失智症狀。FDA表示,Aduhelm是第一種針對阿茲海默症病理生理學基本病因研發的藥物。
部分對象症狀惡化 現腦水腫
不過新藥的研發及審批過程卻充滿爭議,問題主要出在三期臨床試驗中。Biogen分別對Aduhelm進行了兩場代號301和302的三期試驗,兩場實驗設計相同,但結果卻截然相反,在301號實驗中,接受高劑量Aduhelm治療的患者組的認知能力CDR-SB評分升高了2%(代表認知障礙症狀惡化),但在302號實驗中,患者認知能力CDR-SB評分卻降低了22%(代表症狀改善)。Biogen公布的數據亦顯示,接受高劑量Aduhelm的患者中,約35%出現大腦水腫症狀,約18%至22.7%出現微出血症狀。
試驗結果出爐後,Biogen於2019年3月提前叫停試驗,令外界一度以為Aduhelm已經胎死腹中。不過同年10月,Biogen又突然宣布將向FDA提交上市申請,理據是公司分析更多數據後,認為兩項實驗結果都朝着「對患者有利的方向發展」。
恐立危險先例 專家震驚
Biogen於去年7月正式向FDA提交申請,不過FDA獨立專家委員會11月對藥物有效性進行表決時,幾乎所有專家都投了反對票,認為沒有充分證據證明Aduhelm治療阿茲海默症的有效性,而且Biogen未能對兩次三期試驗出現相反結果提出令人信服的解釋。
Biogen表示,Aduhelm獲批後最快可於10日內在美國上市,以每4星期一劑計,一年藥費將需要5.6萬美元(約43.4萬港元)。獨立專家組成員亞歷山大對Aduhelm獲批表示震驚和失望,直言現有數據難有說服力,不少專家亦擔心今次會立下危險先例,降低未來療效有爭議藥物的獲批門檻。
























 字號:
字號:


評論